Большая группа реакций постсинтетической модификации белка связана не с разрывом полипептидной цепи (процессинг), а с преобразованием аминокислотных радикалов К. Обычно оно протекает по мере продвижения белковой молекулы по трубочкам и цистернам ЭР и в аппарате Гольджи. Именно в мембранах этих структур локализованы ферменты, распознающие нужные локусы в молекуле белка и катализирующие соответствующее преобразование строго определенных аминокислот.
- Общая характеристика
- Пептидная связь
- Свойства пептидной связи [ | ]
- Свойства пептидной связи
- Пептидная связь
- Синтез белков обеспечивают рибосомы
- Инициация
- События стадии инициации
- Элонгация
- Последовательность событий стадии элонгации
- Образование пептидной связи при встраивании четвертой аминокислоты в пептид. Субъединицы рибосомы, большая часть транспортных РНК и матричная РНК не показаны
- Терминация
- Реакции стадии терминации
- Полирибосомы
Общая характеристика
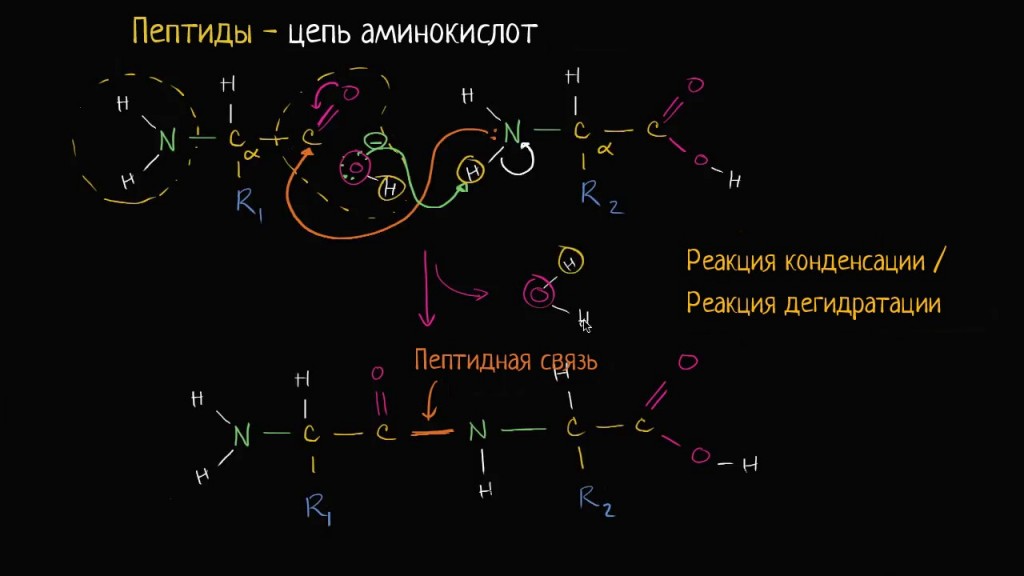
Пептиды — это продукты конденсации двух или более молекул аминокислот. Две молекулы аминокислоты могут реагировать друг с другом с отщеплением молекулы воды и образованием продукта, в котором фрагменты связаны пептидной связью -CO-NH-.
Полученное соединение называют дипептидом. Молекула дипептида, подобно аминокислотам, содержит аминогруппу и карбоксильную группу и может реагировать еще с одной молекулой аминокислоты:
Продукт реакции называется трипептидом. Процесс наращивания пептидной цепи может продолжаться, в принципе, неограниченно и приводить к веществам с очень высокой молекулярной массой (белкам).
Число пептидов, которые могут быть построены из 20 природных аминокислот, огромно. Теоретически можно получить 20n пептидов, содержащих и остатков. Таким образом, может существовать 400 дипептидов, 8000 трипептидов и т.д. При n = 62 число возможных пептидов превосходит число атомов во Вселенной (1080).
Формулы пептидов обычно записывают так, что свободная аминогруппа находится слева (на N-конце цепи), а свободная карбоксильная группа — справа (на С-конце). Основная часть пептидной цепи построена из повторяющихся участков -СН-CO-NH- и боковых групп R, R’ и т.д.
Структуру пептидов, содержащих большое число остатков аминокислот, записывают в сокращенном виде с использованием обозначений, приведенных выше (см. «Аминокислоты», «Общая характеристика»). Например, строение молекулы вазопрессина — пептида, построенного из 9 аминокислотных остатков, можно изобразить следующим образом:
Структурная формула вазопрессина.
Эту же структуру можно изобразить в сокращенном виде с использованием трехбуквенных и однобуквенных обозначений аминокислот:
Сокращенное представление молекулы вазопрессина.
Обратите внимание на то, что в этом пептиде остатки цистеина связаны дисульфидным мостиком. С-конец цепи содержит амидную группу -СО-NН2 вместо карбоксильной.
Химические свойства
Основное свойство пептидов — способность к гидролизу. При гидролизе происходит полное или частичное расщепление пептидной цепи и образуются более короткие пептиды с меньшей молекулярной массой или α-аминокислоты, составляющие цепь. Анализ продуктов полного гидролиза позволяет установить аминокислотный состав пептида. Полный гидролиз происходит при длительном нагревании пептида с концентрированной соляной кислотой.
Последовательность аминокислот в цепи может быть установлена путем частичного гидролиза пептида. Для этого необходимо последовательно, одну за другой, отщеплять аминокислоты от одного из концов цепи и устанавливать их структуру.
Гидролиз пептидов может происходить в кислой или щелочной среде, а также под действием ферментов. В кислой и щелочной средах образуются соли аминокислот. Ферментативный гидролиз важен тем, что протекает селективно, т.е. позволяет расщеплять строго определенные участки пептидной цепи. Интересно, что селективный гидролиз может протекать и под действием неорганических реагентов. Так, бромистый циан (BrCN) расщепляет полипептидную цепь только по пептидной связи, образованной карбоксильной группой метионина
Биологическое значение. Многие пептиды проявляют биологическую активность. Простейший из них — трипептид глутатион, который относится к классу гормонов — веществ, регулирующих процессы жизнедеятельности. Этот гормон построен из остатков аланина, цистеина и глутаминовой кислоты. Известны гормоны, содержащие 9 аминокислотных остатков, — вазопрессин и окситоцин. Вазопрессин повышает кровяное давление, а окситоцин стимулирует выделение молока молочными железами.
- Пептидная связь: образование, строение …
- Пептидная связь
- Аминокислоты. Пептиды. Белки …
Пептидная связь
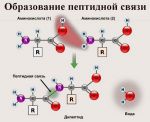
Образование пептидной связи между двумя аминокислотами происходит следующим образом:
Именно из-за амфотерности растворы аминокислот имеют буферные свойства, то есть они способны поддерживать постоянный уровень pH.
Пептидной называют ковалентную связь, возникающую между аминогруппой одной аминокислоты и карбоксильной группой другой аминокислоты.
Соединения, которые при этом образуются, называют пептидами. В зависимости от количества остатков аминокислот, участвующих в реакции поликонденсации, образованные соединения называют ди-, три-, тетра- или полипептидами. Пептид имеет две свободные функциональные группы – аминогруппу и карбоксильную группу.
Способность образовывать пептидные связи имеет фундаментальное значение для живых организмов, ведь именно благодаря этому аминокислоты соединяются друг с другом, образуя пептиды и белки.
Свойства пептидной связи [ | ]
Как и в случае любых амидов, в пептидной связи за счет резонанса канонических структур связь C-N между углеродом карбонильной группы и атомом азота частично имеет характер двойной:
Это проявляется, в частности, в уменьшении её длины до 1,33 ангстрема:
Это обусловливает следующие свойства:
- 4 атома связи (C, N, O и H) и 2 α-углерода находятся в одной плоскости. R-группы аминокислот и водороды при α-углеродах находятся вне этой плоскости.
- H и O в пептидной связи, а также α-углероды двух аминокислот транс-ориентированы (транс-изомер более устойчив). В случае L-аминокислот, что имеет место во всех природных белках и пептидах, R-группы также транс-ориентированы.
- Вращение вокруг связи C-N затруднено, возможно вращение вокруг С-С связи.
Для обнаружения белков и пептидов, а также их количественного определения в растворе используют биуретовую реакцию.
Свойства пептидной связи
Как и в случае любых амидов, в пептидной связи за счет резонанса канонических структур связь C-N между углеродом карбонильной группы и атомом азота частично имеет характер двойной:
Это проявляется, в частности, в уменьшении её длины до 1,33 ангстрема:
Это обусловливает следующие свойства:
- 4 атома связи (C, N, O и H) и 2 α-углерода находятся в одной плоскости. R-группы аминокислот и водороды при α-углеродах находятся вне этой плоскости.
- H и O в пептидной связи, а также α-углероды двух аминокислот трансориентированы (транс-изомер более устойчив). В случае L-аминокислот, что имеет место во всех природных белках и пептидах, R-группы также трансориентированы.
- Вращение вокруг связи C-N затруднено, возможно вращение вокруг С-С связи.
Для обнаружения белков и пептидов, а также их количественного определения в растворе используют биуретовую реакцию.
Первичная структура — последовательность аминокислот в полипептидной цепи. Важными особенностями первичной структуры являются консервативные мотивы — сочетания аминокислот, играющих ключевую роль в функциях белка. Консервативные мотивы сохраняются в процессе эволюции видов, по ним часто удаётся предсказать функцию неизвестного белка.
Структуры
Пептидная связь
В белках аминокислотные остатки связаны между собой с помощью пептидных связей (разновидность ковалентных амидных связей) ( 3 ), в образовании которых участвуют карбоксильная группа одной аминокислоты и аминогруппа другой ( 4 ▼ ). Радикалы аминокислот, как правило, не принимают участие в образовании пептидных связей, однако есть и исключения. Пример: пептидглутатион имеет пептидную связь между аминогруппой цистеина и карбоксильной группой боковой цепи глутамата.
Пептидная группасвязи C-N
Рис. 3. Пептидная связь.
Рис. 4. Образование пептидной связи между двумя аминокислотами.
Рис. 5. Пептидная группа. Длина химических связей выражена в ангстремах (Å), а углы — в градусах.
Длина пептидной связи C-N на 0,13 Å1 короче длины простой ковалентной связи C-N. Иными словами, пептидная связь имеет характер «полудвойной» ковалентной связи.
Конформация и торсионные углы полипептидного скелета стерически фиксированы, поскольку вращение вокруг связей Cα -C2 и Cα -N привело бы к чрезмерному сближению атомов амидноговодорода , карбонильногокислорода или радикала ( 6 ▼ ).
1 Ангстрем — единица измерения расстояний. 1 Å = 1,0 × 10–10 м = 0,1 нм
2 C α — α-атом углерода в молекуле аминокислоты (атом, с которым связана амино- и карбоксильная группа).
Рис. 6. Торсионные углы полипептидного ске-
лета. На рисунке показаны две плоские пептидные группы. Вращение возможно только относительно связей Cα -C (ψ) и Cα -N (φ). Углы этого вращения обозначены как φ и ψ.
Синтез белков обеспечивают рибосомы
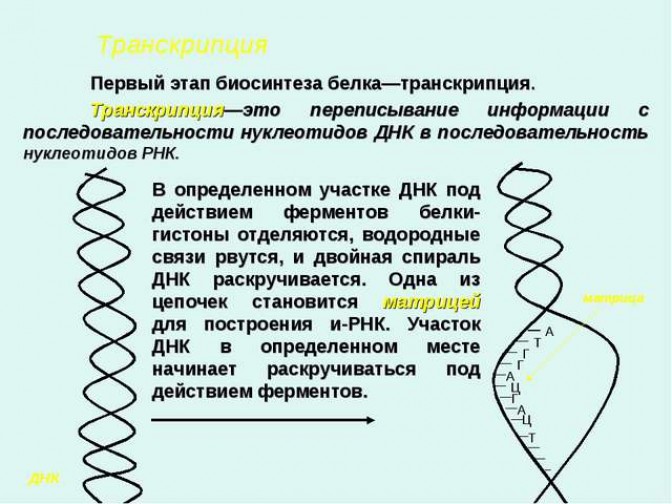
Трансляция (англ. translation – перевод) – это биосинтез белка на матрице мРНК.
После переноса информации с ДНК на матричную РНК начинается синтез белков. Каждая зрелая мРНК несет информацию только об одной полипептидной цепи. Если клетке необходимы другие белки, то необходимо транскрибировать мРНК с иных участков ДНК.
Биосинтез белков или трансляция происходит на рибосомах, внутриклеточных белоксинтезирующих органеллах, и включает 5 ключевых элементов:
- матрица – матричная РНК,
- растущая цепь – полипептид,
- субстрат для синтеза – 20 протеиногенных аминокислот,
- источник энергии – ГТФ,
- рибосомальные белки, рРНК и белковые факторы.
Выделяют три основных стадии трансляции: инициация, элонгация, терминация.
Инициация
Для инициации необходимы мРНК, ГТФ, малая и большая субъединицы рибосомы, три белковых фактора инициации (ИФ-1, ИФ-2, ИФ-3), метионин и тРНК для метионина.
В начале этой стадии формируются два тройных комплекса:
- первый комплекс – мРНК + малая субъединица + ИФ-3,
- второй комплекс – метионил-тРНК + ИФ-2 + ГТФ.
После формирования тройные комплексы объединяются с большой субъединицей рибосомы. В этом процессе активно участвуют белковые факторы инициации, источником энергии служит ГТФ.
После сборки комплекса инициирующая метионил-тРНК связывается с первым кодоном АУГ матричной РНК и располагается в П-центре (пептидильный центр) большой субъединицы.
А-центр (аминоацильный центр) остается свободным, он будет задействован на стадии элонгации для связывания аминоацил-тРНК.
События стадии инициации
После присоединения большой субъединицы начинается стадия элонгации.
Элонгация
Для этой стадии необходимы все 20 аминокислот, тРНК для всех аминокислот, белковые факторы элонгации, ГТФ. Удлинение цепи происходит со скоростью примерно 20 аминокислот в секунду.
Элонгация представляет собой циклический процесс. Первый цикл (и следующие циклы) элонгации включает три шага:
- Присоединение аминоацил-тРНК (еще второй) к кодону мРНК (еще второму), аминокислота при этом встраивается в А-центр рибосомы. Источником энергии служит ГТФ.
- Фермент пептидилтрансфераза осуществляет перенос метионина с метионил-тРНК (в П-центре) на вторую аминоацил-тРНК (в А-центре) с образованием пептидной связи между метионином и второй аминокислотой. При этом уже активированная СООН-группа метионина связывается со свободной NH2-группой второй аминокислоты. Здесь источником энергии служит макроэргическая связь между аминокислотой и тРНК.
- Фермент транслоказа перемещает мРНК относительно рибосомы таким образом, что первый кодон АУГ оказывается вне рибосомы, второй кодон (на рисунке ) становится напротив П-центра, напротив А-центра оказывается третий кодон (на рисунке ). Для этих процессов необходима затрата энергии ГТФ. Так как вместе с мРНК перемещаются закрепленные на ней тРНК, то инициирующая первая тРНК выходит из рибосомы, вторая тРНК с дипептидом помещается в П-центр.
Последовательность событий стадии элонгации
Второе повторение цикла – начинается с присоединения третьей аминоацил-тРНК к третьему кодону мРНК, аминокислота-3 становится в А-центр. Далее трансферазная реакции повторяется и образуется трипептид, занимающий А-центр, после чего он смещается в П-центр в транслоказной реакции..
В пустой А-центр входит четвертая аминоацил-тРНК и начинается третий цикл элонгации:
Образование пептидной связи при встраивании четвертой аминокислоты в пептид. Субъединицы рибосомы, большая часть транспортных РНК и матричная РНК не показаны
Цикл элонгации (реакции 1,2,3) повторяется столько раз, сколько аминокислот необходимо включить в полипептидную цепь.
Терминация
Синтез белка продолжается до тех пор, пока рибосома не достигнет на мРНК особых терминирующих кодонов – стоп-кодонов УАА, УАГ, УГА. Данные триплеты не кодируют ни одной из аминокислот, их также называют нонсенс-кодоны. При вхождении этих кодонов внутрь рибосомы происходит активация белковых факторов терминации, которые последовательно катализируют:
- Гидролитическое отщепление полипептида от конечной тРНК.
- Отделение от П-центра последней, уже пустой, тРНК.
- Диссоциацию рибосомы.
Источником энергии для завершения трансляции является ГТФ.
Реакции стадии терминации
Полирибосомы
По причине того, что продолжительность жизни матричной РНК невелика, перед клеткой стоит задача использовать ее максимально эффективно, т.е. получить максимальное количество “белковых копий”.
Для достижения этой цели на каждой мРНК может располагаться не одна, а несколько рибосом, встающих последовательно друг за другом и синтезирующих пептидные цепи.
Такие образования называются полирибосомы.
Вы можете спросить или оставить свое мнение.
- ВКонтакте
Download SocComments v1.3