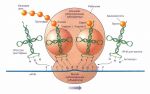
Большая группа реакций постсинтетической модификации белка связана не с разрывом полипептидной цепи (процессинг), а с преобразованием аминокислотных радикалов К. Обычно оно протекает по мере продвижения белковой молекулы по трубочкам и цистернам ЭР и в аппарате Гольджи. Именно в мембранах этих структур локализованы ферменты, распознающие нужные локусы в молекуле белка и катализирующие соответствующее преобразование строго определенных аминокислот.
Общая характеристика
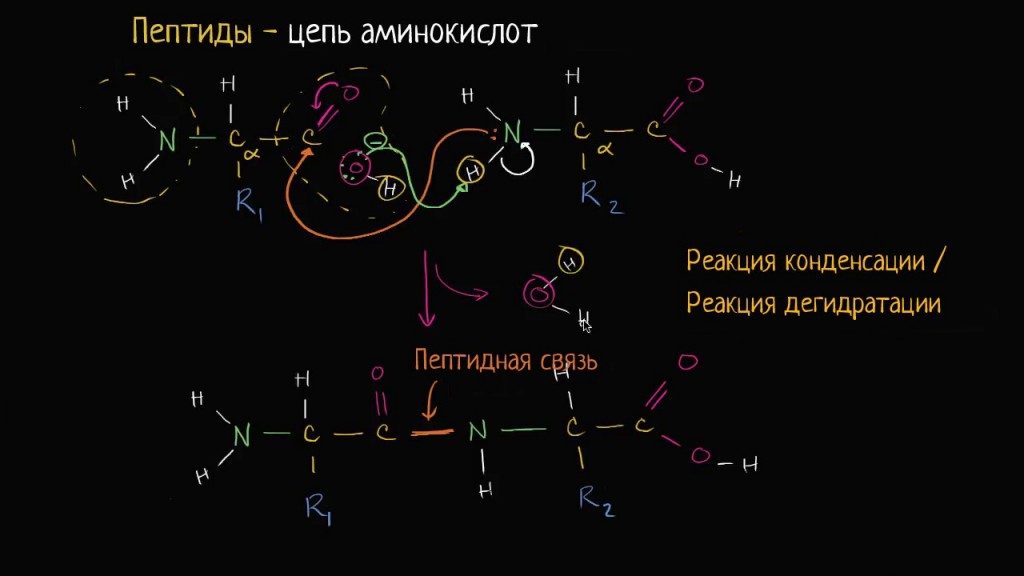
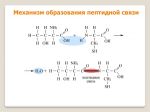
Пептиды — это продукты конденсации двух или более молекул аминокислот. Две молекулы аминокислоты могут реагировать друг с другом с отщеплением молекулы воды и образованием продукта, в котором фрагменты связаны пептидной связью -CO-NH-.
Полученное соединение называют дипептидом. Молекула дипептида, подобно аминокислотам, содержит аминогруппу и карбоксильную группу и может реагировать еще с одной молекулой аминокислоты:
Продукт реакции называется трипептидом. Процесс наращивания пептидной цепи может продолжаться, в принципе, неограниченно и приводить к веществам с очень высокой молекулярной массой (белкам).
Число пептидов, которые могут быть построены из 20 природных аминокислот, огромно. Теоретически можно получить 20n пептидов, содержащих и остатков. Таким образом, может существовать 400 дипептидов, 8000 трипептидов и т.д. При n = 62 число возможных пептидов превосходит число атомов во Вселенной (1080).
Формулы пептидов обычно записывают так, что свободная аминогруппа находится слева (на N-конце цепи), а свободная карбоксильная группа — справа (на С-конце). Основная часть пептидной цепи построена из повторяющихся участков -СН-CO-NH- и боковых групп R, R’ и т.д.
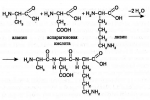
Структуру пептидов, содержащих большое число остатков аминокислот, записывают в сокращенном виде с использованием обозначений, приведенных выше (см. «Аминокислоты», «Общая характеристика»). Например, строение молекулы вазопрессина — пептида, построенного из 9 аминокислотных остатков, можно изобразить следующим образом:
Структурная формула вазопрессина.
Эту же структуру можно изобразить в сокращенном виде с использованием трехбуквенных и однобуквенных обозначений аминокислот:
Сокращенное представление молекулы вазопрессина.
Обратите внимание на то, что в этом пептиде остатки цистеина связаны дисульфидным мостиком. С-конец цепи содержит амидную группу -СО-NН2 вместо карбоксильной.
Химические свойства
Основное свойство пептидов — способность к гидролизу. При гидролизе происходит полное или частичное расщепление пептидной цепи и образуются более короткие пептиды с меньшей молекулярной массой или α-аминокислоты, составляющие цепь. Анализ продуктов полного гидролиза позволяет установить аминокислотный состав пептида. Полный гидролиз происходит при длительном нагревании пептида с концентрированной соляной кислотой.
Последовательность аминокислот в цепи может быть установлена путем частичного гидролиза пептида. Для этого необходимо последовательно, одну за другой, отщеплять аминокислоты от одного из концов цепи и устанавливать их структуру.
Гидролиз пептидов может происходить в кислой или щелочной среде, а также под действием ферментов. В кислой и щелочной средах образуются соли аминокислот. Ферментативный гидролиз важен тем, что протекает селективно, т.е. позволяет расщеплять строго определенные участки пептидной цепи. Интересно, что селективный гидролиз может протекать и под действием неорганических реагентов. Так, бромистый циан (BrCN) расщепляет полипептидную цепь только по пептидной связи, образованной карбоксильной группой метионина
Биологическое значение. Многие пептиды проявляют биологическую активность. Простейший из них — трипептид глутатион, который относится к классу гормонов — веществ, регулирующих процессы жизнедеятельности. Этот гормон построен из остатков аланина, цистеина и глутаминовой кислоты. Известны гормоны, содержащие 9 аминокислотных остатков, — вазопрессин и окситоцин. Вазопрессин повышает кровяное давление, а окситоцин стимулирует выделение молока молочными железами.
- Пептидная связь: образование, строение …
- Пептидная связь
- Аминокислоты. Пептиды. Белки …
Историческая справка: пептидная школа в СССР
В 1959 году в Академии наук СССР был создан Институт химии природных соединений, во главе которого встал академик Михаил Михайлович Шемякин (1908–1970). Сотрудники института с самого начала были ориентированы на изучение природных биорегуляторов, таких как витамины и антибиотики. Большую работу по синтезу пептидных антибиотиков вёл молодой инициативный учёный — будущий директор института и вице-президент АН СССР Юрий Анатольевич Овчинников (1934–1988).
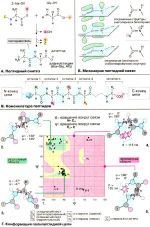
«Визитной карточкой» Института на долгие годы стал валиномицин — депсипептидный циклический антибиотик из бактерий Streptomyces fulvissimus, — синтез которого осуществила команда под руководством Овчинникова [2], доказав заодно ошибочность существовавших ранее представлений о структуре этого вещества (рис. 1). Валиномицин оказался ионофором, то есть веществом, селективно увеличивающим проницаемость биологической липидной мембраны для определённого типа ионов. Конформационное исследование валиномицина и его комплексов с ионами калия (а именно их он и переносит через мембрану) позволило сформулировать механизм работы антибиотика [3]. Ион металла, как в браслет, помещается в центр полости, присутствующей в циклической молекуле, и без энергетических затрат переносится через клеточную мембрану, — что и приводит к «обнулению» калиевого трансмембранного потенциала и, в конечном счёте, к гибели микроорганизма.
Рисунок 1. На лабораторном коллоквиуме в Институте химии природных соединений (1965 г.). Структуру циклического антибиотика валиномицина на доске рисует В.Т. Иванов. Депсипептиды, к которым относится и валиномицин, содержат наряду с «классическими» пептидными связями также одну или несколько сложноэфирных групп.
Блестящий пример валиномицина и других ионофоров, плюс шедшие параллельно в США исследования краун-эфиров, также способных к формированию прочных комплексов с ионами металлов, породили по всему миру каскад работ, приведших к становлению контейнерной химии, основанной на концепции «хозяин-гость» [4]. За работы в этой области Дональд Крам, Жан-Мари Лен и Чарльз Педерсен в 1987 году были удостоены Нобелевской премии по химии. Кстати, пространственная структура трансмембранного калиевого канала, полученная уже в XXI веке, показала, что механизм переноса и селективности к иону K+ у этого белка принципиально такой же, как и в случае валиномицина, — только в канале координационную сферу иона образуют аминокислотные остатки из субъединиц канала-тетрамера [5], а в антибиотике это остов самой циклической молекулы-депсипептида.
За огромную работу по исследованию валиномицина и других ионофоров, результаты которой суммированы в монографии «Мембрано-активные комплексоны», Ю. А. Овчинников и В. Т. Иванов — нынешний директор Института биоорганической химии РАН (ИБХ — так сегодня называется институт, созданный Шемякиным) — были в 1987 году удостоены Ленинской премии. А в память о том романтическом периоде в биоорганической химии около входа в ИБХ красуется статуя, изображающая комплекс валиномицина с ионом калия.
Свойства пептидной связи [ | ]
Как и в случае любых амидов, в пептидной связи за счет резонанса канонических структур связь C-N между углеродом карбонильной группы и атомом азота частично имеет характер двойной:
Это проявляется, в частности, в уменьшении её длины до 1,33 ангстрема:
Это обусловливает следующие свойства:
- 1.5. Белки
- Аминокислоты — Википедия
- Образование пептидной связи рибосома …
- 4 атома связи (C, N, O и H) и 2 α-углерода находятся в одной плоскости. R-группы аминокислот и водороды при α-углеродах находятся вне этой плоскости.
- H и O в пептидной связи, а также α-углероды двух аминокислот транс-ориентированы (транс-изомер более устойчив). В случае L-аминокислот, что имеет место во всех природных белках и пептидах, R-группы также транс-ориентированы.
- Вращение вокруг связи C-N затруднено, возможно вращение вокруг С-С связи.
Для обнаружения белков и пептидов, а также их количественного определения в растворе используют биуретовую реакцию.
Пептидная связь
В белках аминокислотные остатки связаны между собой с помощью пептидных связей (разновидность ковалентных амидных связей) ( 3 ), в образовании которых участвуют карбоксильная группа одной аминокислоты и аминогруппа другой ( 4 ▼ ). Радикалы аминокислот, как правило, не принимают участие в образовании пептидных связей, однако есть и исключения. Пример: пептидглутатион имеет пептидную связь между аминогруппой цистеина и карбоксильной группой боковой цепи глутамата.
Пептидная группасвязи C-N
Рис. 3. Пептидная связь.
Рис. 4. Образование пептидной связи между двумя аминокислотами.
Рис. 5. Пептидная группа. Длина химических связей выражена в ангстремах (Å), а углы — в градусах.
Длина пептидной связи C-N на 0,13 Å1 короче длины простой ковалентной связи C-N. Иными словами, пептидная связь имеет характер «полудвойной» ковалентной связи.
Конформация и торсионные углы полипептидного скелета стерически фиксированы, поскольку вращение вокруг связей Cα -C2 и Cα -N привело бы к чрезмерному сближению атомов амидноговодорода , карбонильногокислорода или радикала ( 6 ▼ ).
1 Ангстрем — единица измерения расстояний. 1 Å = 1,0 × 10–10 м = 0,1 нм
2 C α — α-атом углерода в молекуле аминокислоты (атом, с которым связана амино- и карбоксильная группа).
Рис. 6. Торсионные углы полипептидного ске-
лета. На рисунке показаны две плоские пептидные группы. Вращение возможно только относительно связей Cα -C (ψ) и Cα -N (φ). Углы этого вращения обозначены как φ и ψ.
Разрыв белков
Изучая, что такое пептидная связь, обычно учитывают ее прочность. Такие цепочки не разрываются сами по себе при нормальных условиях внутри клетки. То есть при подходящей температуре тела и нейтральной среде.
В условиях лаборатории гидролиз белковых пептидных цепочек изучают в запаянных ампулах, внутри которых находится концентрированная соляная кислота, при температуре свыше ста пяти градусов по Цельсию. Полностью белковый гидролиз до состояния свободных аминокислот происходит примерно за 24 часа.
К вопросу от том, что такое пептидная связь внутри живых организмов, то в них разрыв происходит при участии определенных ферментов-протеолитов. Дабы отыскать в растворе пептиды и белки, а также узнать их количество, пользуются положительным результатом веществ, которые содержат в себе две или более пептидные связи, то есть биуретовую реакцию.
Роль пептидов
Пептиды достаточно широко представлены в живой природе. Это важные биологические соединения, которые выполняют самые различные функции.
К пептидам относится большая группа веществ, которые называют нейропептидами. Они обнаружены в мозге и способны влиять на функции центральной нервной системы человека и высших животных. Нейромедиаторы энкефалины и эндоморфины действуют на рецепторы головного мозга и способны подавлять боль и вызвать состояние эйфории.
АКТГ – пептид, образованный 39 аминокислотными остатками выделяется гипофизом и играет важную роль в регуляции гормональной деятельности человека. К пептидам относятся и другие регуляторные гормоны гипофиза и гипоталамуса.
Кроме нервной системы, пептидные вещества выделяются и в других частях организма. Тканевые (кинины) гормоны регулируют кровяное давление и сокращение мышц. В 1964 г. был открыт пептидный гормон кальцитонин, который регулирует обмен кальция. Он выделяется паращитовидными железами. Глюкагон – 29-членный пептид, который выделяется поджелудочной железой и вызывает повышение содержания глюкозы в крови, стимулируя расщепление гликогена. Пептидную природу имеют гормоны желудочно-кишечного тракта (гастрин, секретин и т.п.).
Много токсичные вещества – это тоже пептиды. Среди них самыми известными являются токсины ядовитых грибов (микотоксины), пчел и морских беспозвоночных.
- белки свойства и функции
- Биологически важные вещества — белки …
- Презентация на тему: «Часть 8 …
Токсины змей и ракообразных – это соединения, промежуточные между пептидами и белками.
Токсины и яды издавна привлекают внимание медицины из-за широкого спектра использования. Среди микотоксинов встречаются пептиды циклического строения, в которых конечная аминогруппа связана с конечной карбоксильной группой пептидной связью.
Например, яд бледной поганки. Это очень токсичное вещество. Главный компонент пчелиного яда – пептид мелитин (30-50% высушенного яда). Он состоит из 26 аминокислотных остатков. Главная биологическое действие этого токсина обусловлено способностью нарушать структуру клеточных мембран. Другой пчелиный пептид апамин, который образован 18 аминокислотными остатками, является одним из самых известных в биохимии нейротоксинов.
Пептидные антибиотики – это также циклические пептидные соединения. Например, антибиотик циклоспорин обладает выраженным иммунодепрессивным свойством (он подавляет иммунитет). Он широко используется при трансплантации (пересадке) внутренних органов и тканей.