Большая группа реакций постсинтетической модификации белка связана не с разрывом полипептидной цепи (процессинг), а с преобразованием аминокислотных радикалов К. Обычно оно протекает по мере продвижения белковой молекулы по трубочкам и цистернам ЭР и в аппарате Гольджи. Именно в мембранах этих структур локализованы ферменты, распознающие нужные локусы в молекуле белка и катализирующие соответствующее преобразование строго определенных аминокислот.
Общая характеристика
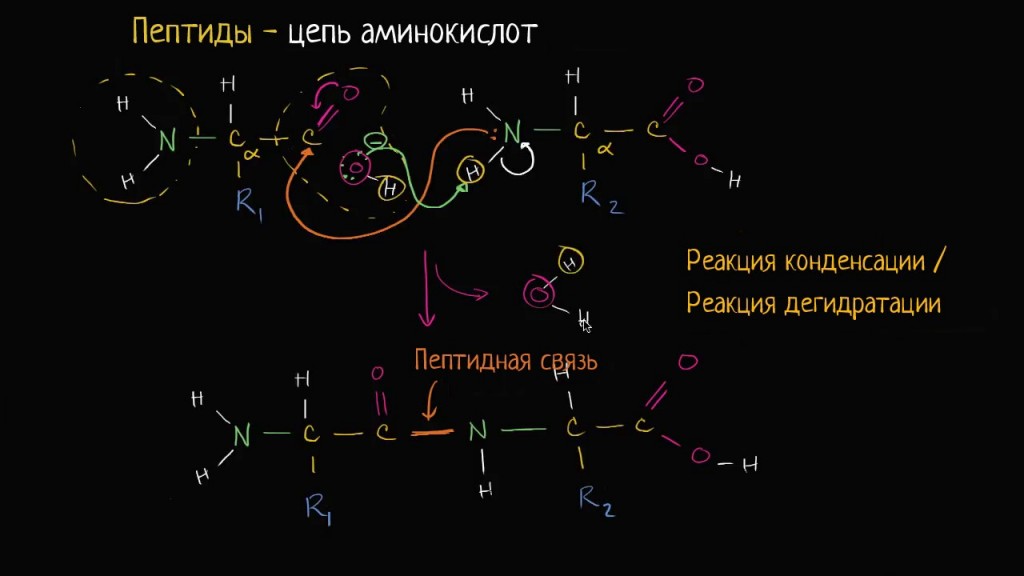
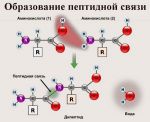
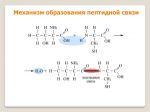
Пептиды — это продукты конденсации двух или более молекул аминокислот. Две молекулы аминокислоты могут реагировать друг с другом с отщеплением молекулы воды и образованием продукта, в котором фрагменты связаны пептидной связью -CO-NH-.
Полученное соединение называют дипептидом. Молекула дипептида, подобно аминокислотам, содержит аминогруппу и карбоксильную группу и может реагировать еще с одной молекулой аминокислоты:
Продукт реакции называется трипептидом. Процесс наращивания пептидной цепи может продолжаться, в принципе, неограниченно и приводить к веществам с очень высокой молекулярной массой (белкам).
Число пептидов, которые могут быть построены из 20 природных аминокислот, огромно. Теоретически можно получить 20n пептидов, содержащих и остатков. Таким образом, может существовать 400 дипептидов, 8000 трипептидов и т.д. При n = 62 число возможных пептидов превосходит число атомов во Вселенной (1080).
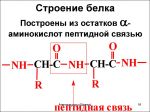
Формулы пептидов обычно записывают так, что свободная аминогруппа находится слева (на N-конце цепи), а свободная карбоксильная группа — справа (на С-конце). Основная часть пептидной цепи построена из повторяющихся участков -СН-CO-NH- и боковых групп R, R’ и т.д.
Структуру пептидов, содержащих большое число остатков аминокислот, записывают в сокращенном виде с использованием обозначений, приведенных выше (см. «Аминокислоты», «Общая характеристика»). Например, строение молекулы вазопрессина — пептида, построенного из 9 аминокислотных остатков, можно изобразить следующим образом:
Структурная формула вазопрессина.
Эту же структуру можно изобразить в сокращенном виде с использованием трехбуквенных и однобуквенных обозначений аминокислот:
Сокращенное представление молекулы вазопрессина.
Обратите внимание на то, что в этом пептиде остатки цистеина связаны дисульфидным мостиком. С-конец цепи содержит амидную группу -СО-NН2 вместо карбоксильной.
Химические свойства
Основное свойство пептидов — способность к гидролизу. При гидролизе происходит полное или частичное расщепление пептидной цепи и образуются более короткие пептиды с меньшей молекулярной массой или α-аминокислоты, составляющие цепь. Анализ продуктов полного гидролиза позволяет установить аминокислотный состав пептида. Полный гидролиз происходит при длительном нагревании пептида с концентрированной соляной кислотой.
Последовательность аминокислот в цепи может быть установлена путем частичного гидролиза пептида. Для этого необходимо последовательно, одну за другой, отщеплять аминокислоты от одного из концов цепи и устанавливать их структуру.
Гидролиз пептидов может происходить в кислой или щелочной среде, а также под действием ферментов. В кислой и щелочной средах образуются соли аминокислот. Ферментативный гидролиз важен тем, что протекает селективно, т.е. позволяет расщеплять строго определенные участки пептидной цепи. Интересно, что селективный гидролиз может протекать и под действием неорганических реагентов. Так, бромистый циан (BrCN) расщепляет полипептидную цепь только по пептидной связи, образованной карбоксильной группой метионина
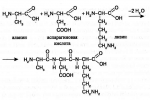
Биологическое значение. Многие пептиды проявляют биологическую активность. Простейший из них — трипептид глутатион, который относится к классу гормонов — веществ, регулирующих процессы жизнедеятельности. Этот гормон построен из остатков аланина, цистеина и глутаминовой кислоты. Известны гормоны, содержащие 9 аминокислотных остатков, — вазопрессин и окситоцин. Вазопрессин повышает кровяное давление, а окситоцин стимулирует выделение молока молочными железами.
- Пептидная связь: образование, строение …
- Пептидная связь
- Аминокислоты. Пептиды. Белки …
- 1.5. Белки
Историческая справка: пептидная школа в СССР
В 1959 году в Академии наук СССР был создан Институт химии природных соединений, во главе которого встал академик Михаил Михайлович Шемякин (1908–1970). Сотрудники института с самого начала были ориентированы на изучение природных биорегуляторов, таких как витамины и антибиотики. Большую работу по синтезу пептидных антибиотиков вёл молодой инициативный учёный — будущий директор института и вице-президент АН СССР Юрий Анатольевич Овчинников (1934–1988).
«Визитной карточкой» Института на долгие годы стал валиномицин — депсипептидный циклический антибиотик из бактерий Streptomyces fulvissimus, — синтез которого осуществила команда под руководством Овчинникова [2], доказав заодно ошибочность существовавших ранее представлений о структуре этого вещества (рис. 1). Валиномицин оказался ионофором, то есть веществом, селективно увеличивающим проницаемость биологической липидной мембраны для определённого типа ионов. Конформационное исследование валиномицина и его комплексов с ионами калия (а именно их он и переносит через мембрану) позволило сформулировать механизм работы антибиотика [3]. Ион металла, как в браслет, помещается в центр полости, присутствующей в циклической молекуле, и без энергетических затрат переносится через клеточную мембрану, — что и приводит к «обнулению» калиевого трансмембранного потенциала и, в конечном счёте, к гибели микроорганизма.
Рисунок 1. На лабораторном коллоквиуме в Институте химии природных соединений (1965 г.). Структуру циклического антибиотика валиномицина на доске рисует В.Т. Иванов. Депсипептиды, к которым относится и валиномицин, содержат наряду с «классическими» пептидными связями также одну или несколько сложноэфирных групп.
Блестящий пример валиномицина и других ионофоров, плюс шедшие параллельно в США исследования краун-эфиров, также способных к формированию прочных комплексов с ионами металлов, породили по всему миру каскад работ, приведших к становлению контейнерной химии, основанной на концепции «хозяин-гость» [4]. За работы в этой области Дональд Крам, Жан-Мари Лен и Чарльз Педерсен в 1987 году были удостоены Нобелевской премии по химии. Кстати, пространственная структура трансмембранного калиевого канала, полученная уже в XXI веке, показала, что механизм переноса и селективности к иону K+ у этого белка принципиально такой же, как и в случае валиномицина, — только в канале координационную сферу иона образуют аминокислотные остатки из субъединиц канала-тетрамера [5], а в антибиотике это остов самой циклической молекулы-депсипептида.
За огромную работу по исследованию валиномицина и других ионофоров, результаты которой суммированы в монографии «Мембрано-активные комплексоны», Ю. А. Овчинников и В. Т. Иванов — нынешний директор Института биоорганической химии РАН (ИБХ — так сегодня называется институт, созданный Шемякиным) — были в 1987 году удостоены Ленинской премии. А в память о том романтическом периоде в биоорганической химии около входа в ИБХ красуется статуя, изображающая комплекс валиномицина с ионом калия.
Свойства пептидной связи [ | ]
Как и в случае любых амидов, в пептидной связи за счет резонанса канонических структур связь C-N между углеродом карбонильной группы и атомом азота частично имеет характер двойной:
Это проявляется, в частности, в уменьшении её длины до 1,33 ангстрема:
Это обусловливает следующие свойства:
- Аминокислоты — Википедия
- Образование пептидной связи рибосома …
- белки свойства и функции
- Биологически важные вещества — белки …
- 4 атома связи (C, N, O и H) и 2 α-углерода находятся в одной плоскости. R-группы аминокислот и водороды при α-углеродах находятся вне этой плоскости.
- H и O в пептидной связи, а также α-углероды двух аминокислот транс-ориентированы (транс-изомер более устойчив). В случае L-аминокислот, что имеет место во всех природных белках и пептидах, R-группы также транс-ориентированы.
- Вращение вокруг связи C-N затруднено, возможно вращение вокруг С-С связи.
Для обнаружения белков и пептидов, а также их количественного определения в растворе используют биуретовую реакцию.
Свойства цепочки
Реклама
Различные аминокислоты, являющиеся своего рода «строительным материалом» для белка, имеют радикал R.
Вам будет интересно:Край — это что такое?
Как и с любыми амидами, пептидная связь белка цепи C-N с помощью взаимодействия канонических структур между карбонильным углеродом и азотным атомом, как правило имеет свойство двойной. Обычно это находит проявление в снижении ее длины до 1,33 ангстрема.
Все это ведет к следующим выводам:
- C, H, O и N — 4 связных атома, плюс 2 a-углерода располагаются на одной плоскости. Группы R аминокислот и a-углеродные водороды располагаются уже за пределами этой зоны.
- Н и О в пептидной связи аминокислот и a-углероды пары аминокислот являются транс-ориентированными, хотя транс-изомер более стабилен. У L-аминокислот R-группы тоже являются транс-ориентированными, что присутствует во всех пептидах и белках в природе.
- Вращение вокруг цепочки C-N сложно, более вероятно вращение у связи C-C.
Для того чтобы понять, что такое пептидная связь, а также для обнаружения самих пептидов с белками и определения их количества в определенном растворе, пользуются биуретовой реакцией.
Строение и номенклатура пептидов
Ту конечную часть молекулы пептида, на которой расположена аминогруппа, называют N-концом молекулы, а та часть, где находится свободная карбоксильная группа, называется С-концом.
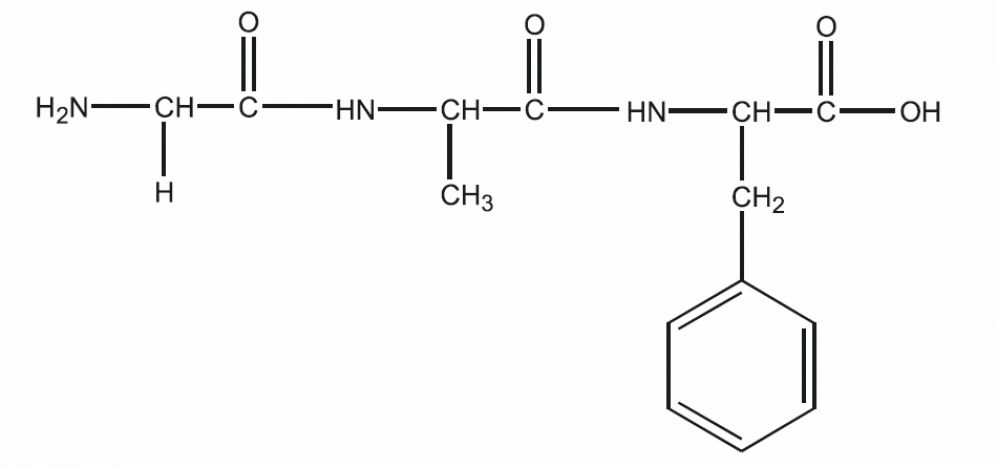
Название пептидов образуется из названий остатков аминокислот, входящих в их состав, начиная с N-концевой аминокислоты. Например, трипептид, образованный из остатков глицина, аланина и фенилаланина, называют глицилаланилфенилаланин:
Для измерения массы в биохимии и молекулярной биологии используют единицу даль тон, названную в честь английского физика и химика Дж. Дальтона.
Пептиды и белки 11
1.6 Пептиды и белки
Различают пептиды ибелки :
первые, как правило, имеют от 2 до нескольких десятков аминокислотных остатков в цепи и не способны выполнять ряд функций белков;
белки имеют от нескольких десятков и болееаминокислотных остатков в цепи и выполняют самые разнообразные функции в организме человека. Кроме того, белки часто называют полипептидами, и это не ошибка. Важно помнить, что полипептид — соединение, состоящее из аминокислотных остатков, связанных между собой пептидными связями, поэтому не все полипептиды
- Презентация на тему: «Часть 8 …
- Аминокислоты, белки — презентация онлайн
- БЕЛКИ Тамбовцева Р.В. Д.б.н., профессор …
- Информационные макромолекулы …
Белки. Примеры физиологически важных пептидов: окситоцин ивазо-
прессин, глутатион.
Окситоцин и вазопрессин — пептидные гормоны, синтезируемые в гипоталамусе. Они состоят из 9 аминокислот и имеют схожую аминокислотную последовательность (лишь 2 аминокислоты из 9 различаются) и имеют разное физиологическое действие.