Рибосомы — субмикроскопические немембранные органеллы, необходимые для синтеза белка. Они объединяют аминокислоты в пептидную цепь, образуя новые белковые молекулы. Биосинтез осуществляется по матричной РНК путем трансляции.
Биосинтез аминокислот
Синтез молекул а-аминокислот требует обязательного включения следующих этапов: а) процесса формирования углеродного скелета; б) фиксации азота с доведением его до состояния аминогруппы; в) введения специфических функциональных групп.
Нетрудно увидеть, анализируя материал предыдущего параграфа, что углеродные цепочки размера с карбоксильной группой образуются в ходе фотосинтеза (пировиноградная и щавелевоукесусная кислоты). Кроме того, из пировиноградной кислоты реакцией окислительного декарбоксилирования получается уксусная кислота, столь необходимая для биосинтеза а-аминокислот и широко используемая Природой в других биосинтетических схемах.
- Биосинтез белка — Биология …
- назовите органические вещества …
- 42. СИНТЕЗ БЕЛКА В ОРГАНИЗМЕ
Азотофиксация столь же важный процесс в природе, что и фиксация углекислого газа, так как осуществляется переход неорганического инертного атмосферного азота в органические азотистые соединения — аминокислоты и белки, в первую очередь, а на последующих этапах — в нуклеиновые основания, алкалоиды и др.
Растениями атмосферный азот не фиксируется и не усваивается. Эти функции выполняют прокариоты — бактерии рода Rhizobium, живущие симбиотрофно в корневых клетках растения-хозяина (бобовые растения, облепиха, ольха), свободно живущие бактерии типа Klebsiella pneumoniae и фотосинтезирующие сине-зеленые водоросли (цианобактерии). Фиксация азота сводится к поглощению его бактериями, где он связывается в виде комплекса ферментом нитрогеназой, осуществляющим постадийное восстановление азота до аммиака. Нитрогеназа представляет собой сложный фермент, в состав которого входят несколько белковых молекул, связанных с достаточно большим количеством атомов сульфидной серы, атомами железа в виде кластеров — это мощная восстановительная система — и двумя атомами молибдена, выполняющими функцию комплексообразователя по отношению к азоту.
Что такое аминокислоты
Разгадка их строения находится в названии. Слово «амино» говорит о наличии аминогруппы – NH2, а «кислоты» — о присутствии в составе кислотной карбоксильной группы – СООН. По-другому, данная группа соединений состоит из карбоновой кислоты, один из атомов водорода которой замещен на аминогруппу.
Формула не так проста: между аминогруппой и карбоксильной группой находится углеродный скелет аминокислоты, который отличается функциональными группами. Поэтому строение аминокислот различно, как и их формулы. Наличие кислотных и основных свойств делает их амфотерными (нейтральными) соединениями. Кислые аминокислоты – не совсем верное выражение, да и вкус у них сладковатый.
Это кристаллические вещества, которые плавятся при высоких температурах (+250°С) и хорошо растворяются в воде, но сохраняют состав в большинстве органических растворителей. Большинство веществ этой группы обладают сладким вкусом.
Они способны образовывать соли, эфиры, но основное химическое свойство аминокислот – это возможность создавать белковые макромолекулы. Соединяясь между собой аминокислоты обрадуют петпиды (кусочки белкового скелета). Две кислоты образуют дипептид:
Три собираются в трипептид, четыре формируют тетрапептид и так постепенно идет сборка белковой макромолекулы. Ответ, зачем нужны аминокислоты, кроется в создании огромного разнообразия белков. Они являются мономерами, из которых строится крупная полимерная нить белка со своей формулой и свойствами.
Представим себе аминокислоту (АМК) в виде бусины. Разные бусины нанизываем на длинную нить. Это первичное строение белка. Затем эту нить сворачиваем в виде зигзага, чтобы некоторые бусинки соприкасались между собой. Так получается вторичная структура. Затем эту нить еще несколько раз скручиваем, чтобы образовался клубок, и выходим на третичную структуру. Несколько бусин-клубков, соединенных вместе, образуют четвертичную структуру. Каждый белок устроен непросто, но благодаря строению и свойствам аминокислот создаются особые конфигурации разных белковых макромолекул со своим строением и уникальной формулой.
Ученые насчитали 200 различных аминокислот, которые встречаются в клетках и тканях разных организмов. Они обнаружены в свободном и связанном виде. Некоторые из них единичны и уникальны: они найдены в отдельных организмах.
Особенности строения
Рибосомы находятся на гранулярном эндоплазматическом ретикулуме или свободно плавают в цитоплазме. Крепятся они к эндоплазматической сети своей большой субъединицей и синтезируют белок, который выводится за пределы клетки, используется всем организмом. Цитоплазменные рибосомы в основном обеспечивают внутренние потребности клетки.
Форма шаровидная или овальная, в диаметре около 20нм.
На этапе трансляции к мРНК может прикрепляться несколько рибосом, образуя новую структуру – полисому. Сами же они образуются в ядрышке, внутри ядра.
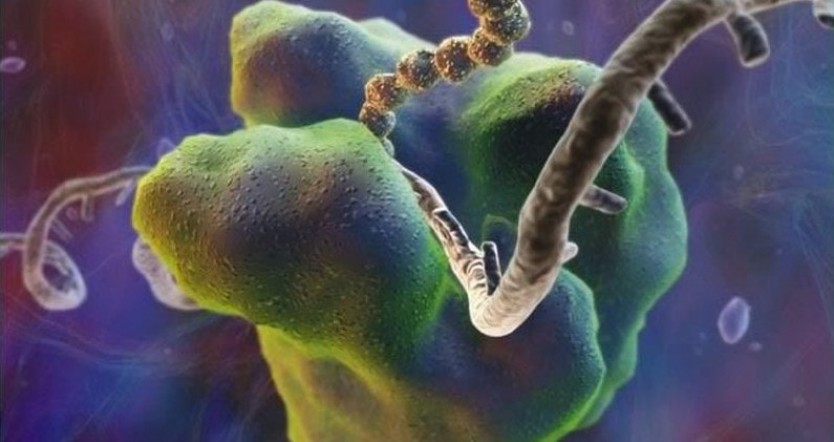
Выделяют 2 вида рибосом:
- Малые – находятся в прокариотических клетках, а также в хлоропластах и митохондриальном матриксе. Они не связаны с мембраной и имеют меньшие размеры (в диаметре до 15нм).
- Большие – находятся в эукариотических клетках, могут достигать в диаметре до 23нм, связываются с эндоплазматической сетью или крепятся к мембране ядра.
Схема строения
Строение обоих видов идентичное. В состав рибосомы входят две субъединицы — большая и малая, которые в сочетании напоминают гриб. Объединяются они при помощи ионов магния, сохраняя между соприкасающимися поверхностями небольшую щель. При дефиците магния субъединицы отдаляются, происходит дезагрегация и рибосомы уже не могут выполнять свои функции.
Химический состав
Рибосомы состоят из высокополимерной рибосомальной РНК и белка в соотношении 1:1. В них сосредоточено примерно 90% всей клеточной РНК. Малая и большая субъединицы содержат около четырех молекул рРНК, которая имеет вид нитей собранных в клубок. Окружены молекулы белками и формируют вместе рибонуклеопротеид.
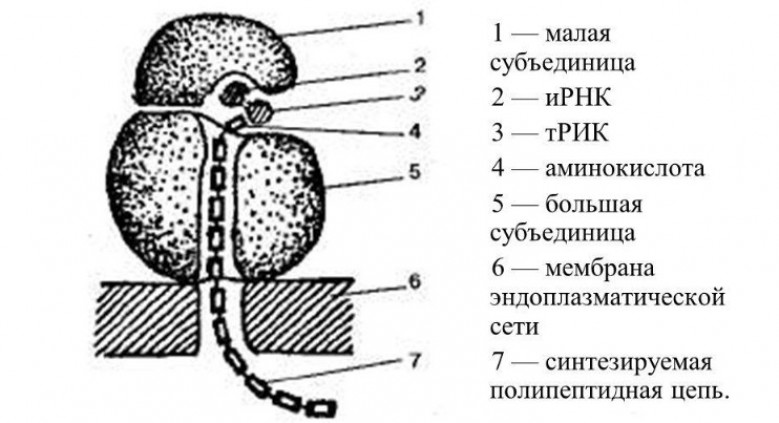
Полирибосомы – это объединение информационной РНК и рибосом, которые нанизываются на нить иРНК. В период отсутствия синтезирующих процессов, рибосомы разъединяются и обмениваются субъединицами. При поступлении иРНК они снова собираются в полирибосомы.
Количество рибосом может изменяться в зависимости от функциональной нагрузки на клетку. Десятки тысяч находятся в клетках с высокой митотической активностью (меристема растений, стволовые клетки).
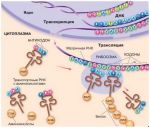
Схема биосинтеза белка
По схеме видно, как протекает процесс.
Точкой стыковки этой схемы являются рибосомы, в которых синтезируется белок. В простой форме синтез осуществляется по схеме
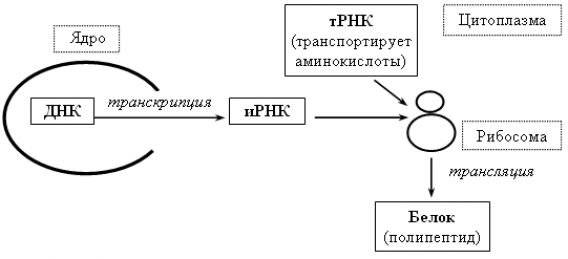
ДНК >, PHK >, белок.
Первым начинается этап транскрипции, в котором молекула изменяется в одноцепочную информационную рибонуклеиновую кислоту (иРНК). В ней содержится информация аминокислотной последовательности белка.
Следующей остановкой иРНК будет рибосома, в которой происходит сам синтез. Происходит это путём трансляции, формирования полипептидной цепочки. После этой заурядной схемы, полученный белок транспортируется в разные места, выполняя определённые задачи.
Этапы биосинтеза белка
Транскрипция
Процесс протекает в ядре. ДНК образована большим количеством нуклеотидов. Это единица макромолекулы. Она включает в свой состав 3 компонента:
-
углевод, представленный пентозой – дезоксирибозой;
-
минеральную кислоту – фосфорную;
-
органическое соединение, относящееся к классу азотистых оснований.
В составе ДНК могут содержаться 4 разных основания. Они имеют краткое обозначение, по первой букве названия:
-
А – аденин;
-
Г – гуанин;
-
Ц – цитозин;
-
Т – тимин.
Именно этими основаниями и отличаются нуклеотиды. Чередование 3 нуклеотидов образует триплет. Один триплет соответствует одной аминокислоте. Вопрос соответствия аминокислот триплетам изучен и указан в таблице генетического кода.
Последовательность триплетов в молекуле дезоксирибонуклеиновой кислоты, отвечающей за синтез одного белка, называют геном. Между разными генами расположены триплеты, которые не соответствуют аминокислотам. Их называют стоп-кодонами. Они служат сигналом начала и окончания гена.
Для осуществления транскрипции, участок макромолекулы ДНК раскручивается. Он выполняет роль матрицы. На нём выстраивается и-РНК. Осуществляется синтез по принципу соответствия. Еще его называют комплементарностью.
РНК также имеет нуклеотидное строение. Вместо дезоксирибозы присутствует углевод рибоза. Содержится остаток ортофосфорной кислоты. Третьим компонентом является азотистое основание. Три основания одинаковые – А, Г, Ц в ДНК и РНК. Четвертое основание рибонуклеиновой кислоты – урацил (У).
Комплементарными основаниями являются: Т – А, А – У, Г – Ц, Ц – Г. В парах комплементарных оснований первое соответствует ДНК, второе – РНК. Таким образом, на макромолекуле ДНК по принципу соответствия выстраивается и-РНК. В дальнейшем цепь РНК транспортируется через ядерную мембрану к месту синтеза белка.
Трансляция
Процесс идет на органоидах – рибосомах. Они нанизываются на цепь и-РНК, передвигаются по ней не плавно, а прерывисто. Располагаются таким образом, что внутри рибосомы находится полностью 1-2 триплета. На одну РНК может одновременно нанизываться большое количество рибосом.
В процессе принимают участие т-РНК. Они имеют пространственную структуру, принимают форму трилистника. Верхняя часть листа, то есть молекулы, содержит антикодон. Это триплет, распознающий кодон (один триплет) и-РНК.
Каждая т-РНК транспортирует к рибосоме строго определенную аминокислоту. Если триплет-антикодон т-РНК распознает триплет-кодон и-РНК, тогда аминокислота встраивается в макромолекулу белка. Следующая т-РНК подтаскивает другую аминокислоту, снова идет процесс распознавания. В данном случае также идет матричный процесс сборки белка. РНК служит матрицей для синтеза белка.
Как только белковая молекула синтезирована, она освобождается от рибосомы. Правильное чередование аминокислот в макромолекуле образует первичную структуру белковой молекулы. Она является определяющей, поэтому так важен матричный синтез белков. Другие структуры белковые макромолекулы приобретают самопроизвольно.
Белки
Белки — это высокомолекулярные (молекулярная масса варьируется от 5-10 тыс. до 1 млн и более) природные полимеры, молекулы которых построены из остатков аминокислот, соединенных амидной (пептидной) связью.
Белки также называют протеинами (греч. «протос» — первый, важный). Число остатков аминокислот в молекуле белка очень сильно колеблется и иногда достигает нескольких тысяч. Каждый белок обладает своей присущей ему последовательностью расположения аминокислотных остатков.
- Биосинтез белка. Виды т-РНК. Код ДНК …
- Презентация по биологии на тему …
- Параграф 10 — Броздецкий В.С. Рабочие …
Белки выполняют разнообразные биологические функции: каталитические (ферменты), регуляторные (гормоны), структурные (коллаген, фиброин), двигательные (миозин), транспортные (гемоглобин, миоглобин), защитные (иммуноглобулины, интерферон), запасные (казеин, альбумин, глиадин) и другие.
Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Выделяют 4 уровня пространственной организации белков.